Mithra Pharmaceuticals déçoit
Nous avons été désagréablement surpris par le rapport annuel du spécialiste liégeois de la santé féminine. Cela dit, le potentiel de l’Estérol ne fait aucun doute, et nous nous attendons à la conclusion de nouveaux accords cette année.
Nous avons été désagréablement surpris par le rapport annuel du spécialiste liégeois de la santé féminine. En particulier par l’annonce du nouveau report du protocole de l’étude de phaseII en cours avec Donesta _ un deuxième candidat médicament à base d’Estétrol, contre les effets secondaires de la ménopause _, et les résultats sont attendus à présent au 1ertrimestre 2018. Ce report doit permettre à Mithra de constituer un dossier solide pour les études de phaseIII et d’accroître ses chances de partenariat. Compte tenu de sa consommation rapide de liquidités, Mithra a décidé de trouver des partenaires dans les régions clés (Europe et États-Unis) pour le développement de la phaseIII avec Donesta, et a annoncé une lettre d’intention avec FujiPharma pour l’extension de l’accord de licence actuel, qui inclurait Donesta.
Fonte de la trésorerie
La trésorerie a fondu en 2016 de 51,1 à 45,7millions, dont 20,2millions au second semestre. Malgré une augmentation des parts de marché en Belgique (+0,97%, à 45,84%), le chiffre d’affaires (CA) sur la vente de contraceptifs oraux génériques a reculé de 1,8million d’euros, à 17millions. Le CA du groupe a cependant augmenté de 10%, à 22,5millions d’euros, grâce à 5,5millions de CA sur l’accord de licence avec Fuji Pharma sur la commercialisation d’Estelle (un possible contraceptif oral à base d’Estétrol) au Japon et dans dix pays d’Asie du Sud-est. Les frais de développement ont sensiblement augmenté, de 9,5millions d’euros à 34,3millions. Avec Estelle, deux études de phaseIII sont en cours en Europe et en Amérique du Nord (au total, sur plus de 3500patients). Le recrutement du volet européen de patients est terminé; les résultats seront connus à partir du troisième trimestre 2018. Et les résultats de l’étude américaine suivront début 2019.
Un autre élément déçoit: la déclaration d’intention annoncée en novembre 2016 pour la conclusion d’un accord de licence pour l’Estétrol avec le plus grand spécialiste de la santé féminine de Chine n’a pas encore débouché sur un contrat (pourtant prévu pour fin février).
De bonnes nouvelles aussi
Cependant, en ce qui concerne le développement de variantes génériques complexes de médicaments à base d’hormones, les nouvelles sont bonnes. Le substitut d’hormone Tibelia a obtenu fin 2016 une approbation dans 14pays européens, et 8accords de distribution ont déjà été conclus. Pour l’anneau vaginal contraceptif générique Myring, la demande d’approbation a été déposée en Europe et aux États-Unis au deuxième trimestre, et un accord de licence exclusif a été signé pour les États-Unis avec Mayne Pharma (paiement d’étape de 2,4millions d’euros).
L’intérêt du marché pour le potentiel de l’Estérol ne fait aucun doute, et nous nous attendons à la conclusion de nouveaux accords cette année. Mais compte tenu de l’importante consommation de liquidités de Mithra en 2017, la probabilité est sensiblement plus grande désormais qu’elle ait besoin d’un financement complémentaire pour tenir jusque fin 2018. La valorisation nettement plus tendue de ses pairs américains pourrait inciter l’entreprise belge à envisager une cotation outre-Atlantique. Digne d’achat (1C).
Avis : digne d’achat
Risque : élevé
Rating : 1C
Devise : euro (EUR)
Marché : Euronext Bruxelles
Capitalisation boursière : 297 millions EUR
C/B 2016 : –
C/B attendu en 2017 : –
Perf. cours sur 12 mois : +15 %
Perf. cours depuis le 01/01 : +5 %
Rendement du dividende : –
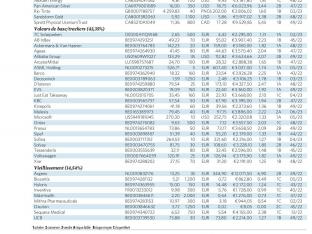
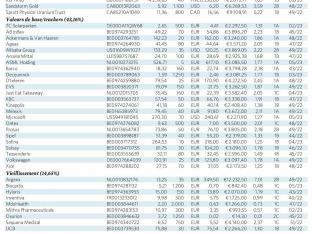
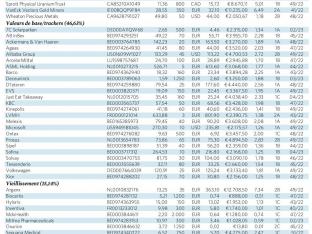
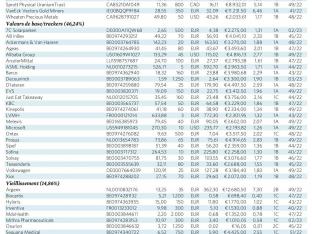
Sélection de nos actions
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici