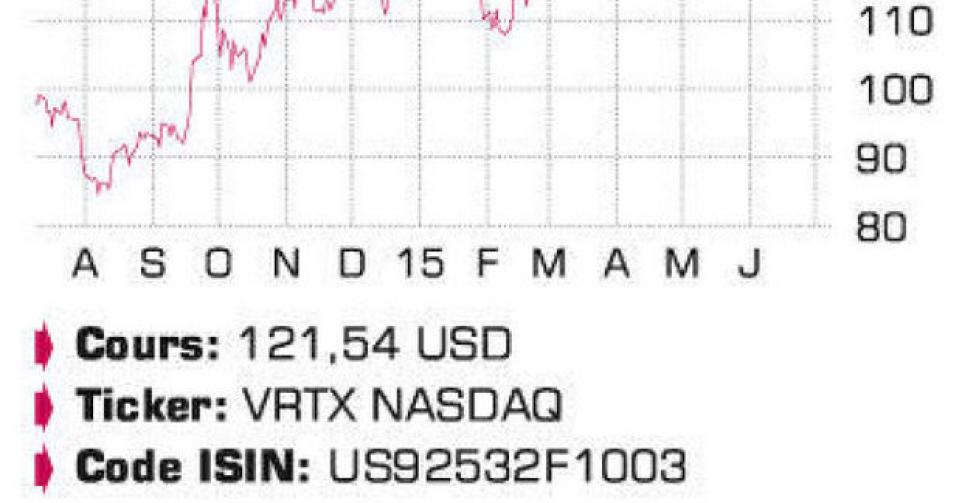
Vertex Pharmaceuticals
Digne d’achat
Comme prévu, la FDA (l’Agence américaine des médicaments) a autorisé Vertex Pharmaceuticals à commercialiser l’Orkambi début juillet. Après le Kalydeco, l’Orkambi est le deuxième produit de Vertex à s’attaquer à la cause primaire de la mucoviscidose chez un sous-groupe de patients. Kalydeco est sur le marché depuis 2012, mais n’est efficace que sur un nombre limité de mutations – principalement les G511D et R117H – qui représentent ensemble environ 5% de la population totale de 7500 patients en Amérique du Nord, en Europe et en Australie. Il générera un chiffre d’affaires (CA) de 560 à 580 millions USD (130 millions USD au 1er trimestre) en 2015, grâce à l’extension de l’application à 3900 patients – au prix élevé de 310.000 USD par patient et par an. Mais la véritable percée de Vertex interviendra avec le lancement aux Etats-Unis de l’Orkambi, une thérapie combinant un potentiateur (Kalydeco) et un correcteur (Lumacaftor; VX809) pour le traitement de la forme homozygote de la mutation F508del. Celle-ci affecte 50% des patients, plus précisément 8500 personnes de plus de 12 ans aux Etats-Unis et 12.000 en Europe, où le produit devrait en principe être approuvé avant la fin de l’année. Des demandes de commercialisation de l’Orkambi ont également été introduites au Canada et en Australie. Aux Etats-Unis, l’Orkambi coûtera 259.000 USD par patient et par an, et le marché table déjà sur un CA de 440 millions USD pour 2015. Le CA du groupe devrait ainsi atteindre 1 milliard USD. Et la croissance devrait se poursuivre au cours des années suivantes : 2,8 milliards USD en 2016, 4,1 milliards USD en 2017 et 5,1 milliards USD en 2018. Les résultats de l’étude américaine de sécurité sur l’Orkambi pour les patients de 6 à 11 ans, un groupe cible supplémentaire de 5500 patients (Etats-Unis et Europe), sont attendus en 2016. Vertex espère également soigner le groupe de patients les plus difficiles à traiter par le biais d’une thérapie combinée triple (Kalydeco, le correcteur VX661 et un autre correcteur à sélectionner cette année) : ceux qui souffrent de la mutation hétérozygote F508del (17.000 patients). En juin, Vertex a annoncé un accord avec Parion Sciences qui lui confère tous les droits sur la poursuite du développement des inhibiteurs de canal sodique (ENaC) de Parion, en particulier les P-1037 et P-1055. Des études précliniques ont révélé que le P-1037 pourrait avoir un effet complémentaire positif sur les patients souffrant de la forme hétérozygote évoquée. Début 2016, Vertex lancera une étude de phase IIa qui comparera l’effet d’une combinaison de l’Orkambi et de P-1037 à celui de l’Orkambi administré seul. Vertex a déjà payé 80 millions USD à la signature d’un contrat qui prévoit au maximum 816 millions USD de paiements d’étapes et des royalties à deux chiffres sur les ventes. Ce deal est essentiel à la stratégie de Vertex : augmenter l’efficacité de ses médicaments pour les patients souffrant de mucoviscidose et conserver ainsi plusieurs années d’avance sur la concurrence.
Conclusion
Nous sommes satisfaits de l’approbation cruciale de l’Orkambi. Vertex est appelée à devenir une véritable machine à liquidités ces prochaines années, et sa position unique dans un marché difficile à pénétrer lui confère le profil d’une proie idéale. Nous maintenons l’action en portefeuille modèle.
Conseil: digne d’achat
Risque: élevé
Rating: 1C
Actions américaines
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici