Bone Therapeutics sous pression
Après le PREOB, c’est à présent le JTA-004 qui déçoit énormément. Il faudra que l’entreprise publie de bonnes nouvelles et si possible rapidement, pour regagner la confiance du marché.
Nous écrivions récemment dans ces colonnes que, pour l’action de cette entreprise de biotechnologie wallonne, l’annonce des résultats de l’étude de phase III évaluant l’effet de la solution protéique enrichie JTA-004 sur l’arthrose du genou serait déterminante. Nous avions anticipé deux issues: une multiplication par deux ou une réduction de moitié du cours. C’est hélas le deuxième scénario qui s’est produit.
Les résultats de l’étude ne montrent, trois mois après le traitement, aucune différence statistique dans la réduction de la douleur au genou entre les patients ayant reçu le JTA-004, ceux ayant reçu un placebo ou ceux auxquels a été administré le produit Hylan G-F 20, du leader du marché Sanofi. La réduction de la douleur, en tant que critère principal, a été mesurée via l’indice de WOMAC, un questionnaire plutôt subjectif, qui suppose un effet placebo accru. Bien que les patients sous placebo aient pris plus de médicaments contre la douleur au cours de l’étude que les patients recevant le JTA-004 ou l’Hylan G-F 20, la différence n’est pas pertinente dans le score WOMAC. Cette différence statistique a cela dit été observée dans un sous-groupe de sujets présentant une arthrose du genou plus sévère. Cela suffira-t-il à convaincre un partenaire de poursuivre le développement ?
Après le PREOB, c’est donc à présent le JTA-004 qui déçoit énormément. Même s’il détonnait, dans le pipeline de la société, où il est entré en 2018, il était permis d’espérer que le viscosupplément de nouvelle génération contribue à en améliorer la santé financière. Désormais, l’attention de tous ne sera plus portée que sur l’activité principale de l’entreprise: le développement de sa plateforme de thérapie cellulaire. Dont l’élément phare est l’ALLOB, le produit de thérapie cellulaire allogénique (fabriqué à partir de cellules de moelle osseuse de sujets sains). L’entreprise espère achever au 1er semestre de 2022 la phase IIb de l’étude qu’elle consacre à des patients souffrant d’une fracture osseuse tardant à guérir; les résultats seront publiés fin 2022.
Miguel Forte, le CEO, s’attelle à élargir le pipeline à la prochaine génération de cellules souches, qui pourront être utilisées dans de nouvelles indications, au-delà du domaine de l’orthopédie. Il a noué au cours des 12 derniers mois un certain nombre de partenariats à cette fin. Ainsi l’entreprise a-t-elle reçu une subvention de la Région wallonne pour développer le BT-20, un candidat médicament contre les pathologies inflammatoires. Le repositionnement de l’entreprise était nécessaire. Reste à espérer de bonnes nouvelles ces prochains mois, indispensables pour que le marché croie à nouveau en Bone Therapeutics. Le temps presse en effet: même si l’entreprise a perçu la première moitié du prêt de 16 millions qu’elle a obtenu auprès de la Banque européenne d’investissement début juillet, sa trésorerie actuelle ne lui permettra pas de poursuivre ses activités au-delà du mois de mai 2022.
Conclusion
En attendant les résultats de l’étude de phase IIb sur l’ALLOB, il faudra que de bonnes nouvelles soient publiées et si possible rapidement, pour que l’entreprise regagne la confiance du marché. Dans l’intervalle, nous abaissons notre conseil. Nous suivrons néanmoins l’entreprise et son action, dans laquelle le portefeuille modèle est pour l’heure investi. Pour l’heure, car l’évolution du cours déterminera si nous la conservons. Par ailleurs, d’autres opportunités pourraient se présenter dans le secteur.
Conseil: conserver/attendre
Risque: élevé
Rating: 2C
Cours: 1,40 euro
Ticker: BOTHE BB
Code ISIN: BE0974280126
Marché: Euronext Bruxelles
Capit. boursière: 23,1 millions EUR
C/B 2020: –
C/B attendu 2021: –
Perf. cours sur 12 mois: -39%
Perf. cours depuis le 01/01: -47%
Rendement du dividende: –
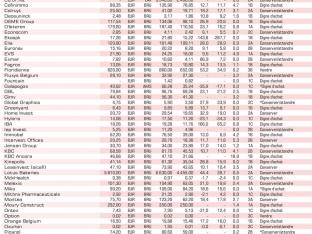
Actions belges
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici